Ansökan till CTIS - Region Skåne
Region Skåne har ett regionalt ansökningsförfarande för kliniska läkemedelsprövningar i EU-portalen Clinical Trials Information System (CTIS)
Ansökan om klinisk prövning i CTIS
Nya ansökningar för klinisk läkemedelsprövning ska göras i den EU-gemensamma webbportalen Clinical Trial Information System (CTIS). Ansökan ska göras av sponsorn, som är det företag, institution eller organisation som ansvarar för att inleda, driva och ordna med finansiering av en klinisk prövning.
I CTIS görs en gemensam tillståndsansökan till Läkemedelsverket och Etikprövningsmyndigheten. Beslutet som lämnas i CTIS omfattar båda myndigheternas gemensamma granskning.
Även sen tidigare godkända kliniska prövningar som är aktiva efter 30 januari 2025 ska överföras till CTIS.
Följ Region Skånes rutiner och riktlinjer
När Region Skåne är sponsor för kliniska läkemedelsprövningar är regionen juridiskt ansvarig. Som användare av Region Skånes CTIS-konto ska du följa regionens rutiner och riktlinjer.
Hantering av personuppgifter i CTIS
Personuppgiftsminimering
Det finns krav på personuppgiftsminimering för till exempel namn, signaturer och kontaktuppgifter i dokumenten. Du kan behöva ladda upp en reviderad version för publicering samt originalversionen som ej för publicering i CTIS.
Instruktion för hantering av personuppgifter i CTIS. Pdf, 375 kB.
Pdf, 375 kB.
Registrering av prövning i CTIS
Region Skåne har beslutat att använda Organisationscentrerat ansökningsförfarande. När Region Skåne är sponsor för en klinisk prövning administreras ansökan i CTIS av Kliniska Studier Sverige – Forum Söder.
Så här gör du
- Registrera ett EMA-konto (länk till annan webbplats)
 Länk till annan webbplats., om du inte har det sedan tidigare (använd @skane.se e-post då Region Skåne är sponsor).
Länk till annan webbplats., om du inte har det sedan tidigare (använd @skane.se e-post då Region Skåne är sponsor). - Mejla användarnamn samt full titel på den kliniska prövningen till studiesupport.sus@skane.se.
- Forum Söder registrerar den kliniska prövningen i CTIS. Prövningen får då sitt EU Clinical Trials nummer och du som ansvarig forskare får åtkomst till prövningen.
Anvisning till ny prövning i CTIS
I CTIS är ansökan uppdelad i olika sektioner och innehåller ett flertal olika obligatoriska dokument. Dessa finns angivna under punkt 1 i Checklista: Livscykel för klinisk prövning i CTIS Pdf, 197 kB..
Pdf, 197 kB..
Om prövningen är multinationell kommer dokumentationen i Part I vara densamma för alla länder med undantag av synopsis, som i många fall ska vara översatt till lokalt språk. I Part II ska alla dokument som laddas upp för Sverige vara på svenska.
Mallar för några av de obligatoriska dokumenten finns på Läkemedelsverkets Länk till annan webbplats. och Kliniska Studier Sveriges webbplatser. Forum Söder har tagit fram ytterligare mallar som kan vara ett stöd i ansökningsprocessen. För att ta del av dem, kontakta oss på studiesupport.sus@skane.se.
Länk till annan webbplats. och Kliniska Studier Sveriges webbplatser. Forum Söder har tagit fram ytterligare mallar som kan vara ett stöd i ansökningsprocessen. För att ta del av dem, kontakta oss på studiesupport.sus@skane.se.
När ansökan har granskats regulatoriskt lämnas meddelande i CTIS under Notices & Alerts. Under både validerings- och granskningsperiod kan sponsorn få frågor - RFI (Request For Information), som ska besvaras inom 10 respektive 12 dagar.
CTIS - tidslinje för handläggning av ansökan
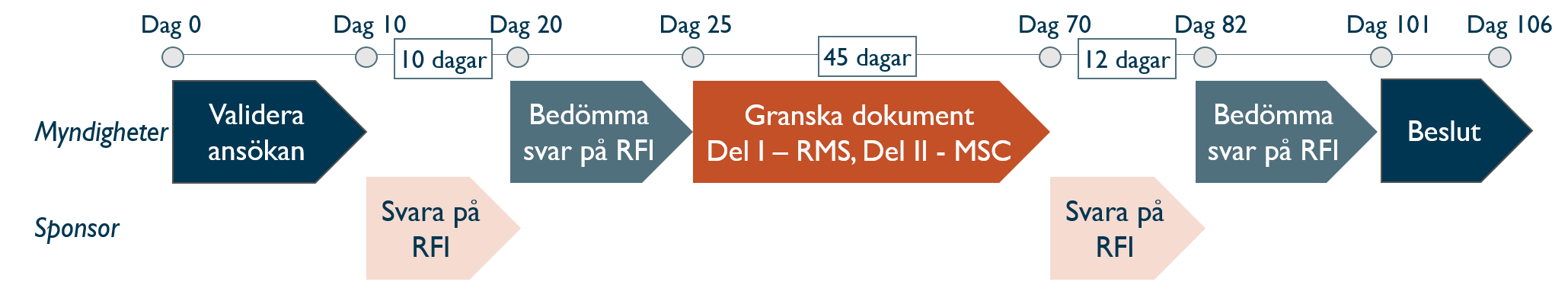
Rapporterande land (RMS) koordinerar granskning av ansökan. För en multinationell ansökan granskas del II av varje medverkande land (MSC). Handläggningstiden är maximalt 106 dagar, men kortas om frågor (RFI) uteblir. Granskning av dokument kan förlängas med max 50 dagar om ansökan inkluderar t.ex. ATMP.
Notera att det inte kommer aviseringar via e-post, utan all kommunikation sker i CTIS.
Uppdatering av prövningens status ska göras när det är aktuellt och ett flertal uppdateringar är obligatoriska, såsom:
- Prövningsstart, ange datum då rekryteringsprocessen startade
- Rekryteringsstart, ange datum då första försökspersonen rekryterades
- Årligen: en säkerhetsrapport (Annual Safety Report) ska skickas in, med start ett år efter det initiala godkännandet
- Rekryteringsavslut, ange datum då sista försökspersonen rekryterats
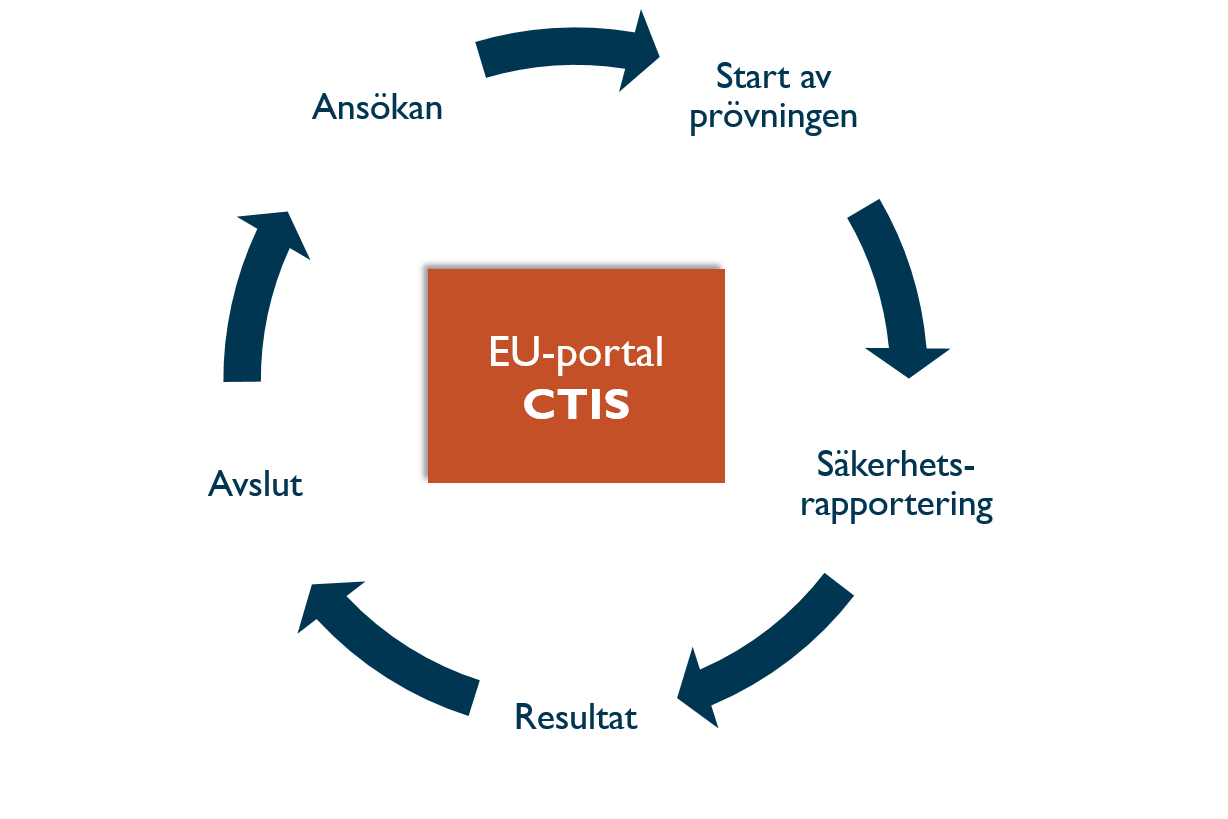
CTIS täcker hela livscykeln för en klinisk prövning, från ansökan, uppdateringar under prövningens gång, till avslut och sammanfattning av resultaten.
Uppdateringar som kan bli aktuella:
- Väsentlig ändring - ansökan ska inlämnas av sponsor
- SUSAR – misstänkt oförutsedd allvarlig händelse
- Serious breach (allvarlig avvikelse)
- Urgent Safety measure (brådskande säkerhetsåtgärd)
- Unexpected event (oväntad händelse)
- Icke-väsentlig ändring – uppdatera information i CTIS men kräver inget nytt godkännande
För dig som ska hantera en ansökan i CTIS där Region Skåne är sponsor har vi tagit fram ett övergripande stöddokument: Instruktion - Ny klinisk prövning Pdf, 509 kB..
Pdf, 509 kB..
Överföring av prövning till CTIS
Kliniska prövningar som godkänts under tidigare regelverk måste överföras till CTIS om de är fortsatt aktiva efter 30 januari 2025. För att hinna behandla ansökningarna bör de registreras i CTIS snarast och skickas in senast 16 oktober 2024.
Endast dokument som tidigare godkänts av Läkemedelsverket och Etikprövnings-myndigheten ska laddas upp i CTIS vid en initial överföring. Dock får senare version användas som endast innehåller icke-väsentliga ändringar.
För de dokument som inte krävdes under det tidigare regelverket ska ett tomt dokument (dummy) laddas upp med förklarande text för att överföringsansökan ska bli valid.
För dig som ska hantera en överföring av pågående klinisk prövning till CTIS där Region Skåne är sponsor har vi tagit fram ett övergripande stöddokument: Instruktion – Överföring av prövning Pdf, 385 kB..
Pdf, 385 kB..
Adresser i CTIS
Adresser för sjukhus registreras enligt uppsatta kriterier, vilket sköts av Region Skånes administratörer (studiesupport.sus@skane.se).
När en verksamhet inom Region Skåne medverkar i en klinisk läkemedelsprövning ska adress till sjukhuset för ansökan hämtas under adresser till prövningsställen.
Den specifika kliniken och gatuadress läggs sen in manuellt i CTIS under ”Department”, tillsammans med prövarens namn, telefonnummer och e-post.
Biobanksansökan vid kliniska prövningar
Om den kliniska prövningen innefattar insamling av humanbiologiska prov ska sponsor skicka in en biobanksansökan till kliniskaprovningar@biobanksverige.se parallellt med ansökan i CTIS (samma dag).
Under granskning av Part II i CTIS-ansökan kommer Regionalt Biobankscentrum (RBC) lämna ett yttrande till Etikprövningsmyndigheten avseende Information till försöksperson och samtyckeblankett. Behov av komplettering i biobanksansökan kan därmed åtgärdas under handläggningen.
Biobanksansökan kan beviljas först efter att den kliniska prövningen har godkänts i CTIS. Biobanksavtalet träder i kraft efter att ansökan undertecknats av behöriga företrädare. Biobank Sverige har mer information om detta på sin webbplats, Kliniska prövningar, Biobank Sverige Länk till annan webbplats..
Länk till annan webbplats..
Tips för arbete i CTIS
Ta del av några tips för att arbeta framgångsrikt i CTIS.
- Använd webbläsaren Chrome när du arbetar i CTIS
- Spara informationen i CTIS regelbundet i samband med inmatning, eftersom detta inte sker automatiskt
- Klicka på symbolen Hänglås som låses för att kunna fylla i och registrera data
- Kontrollera Notices & Alerts i Sponsors workspace i CTIS regelbundet för att inte missa kommunikation från Läkemedelsverket
Kontakta oss
Om du har frågor om ansökningar till CTIS är du välkommen att kontakta oss på studiesupport.sus@skane.se.
Senast publicerad:
